Kategorier
Siste innlegg
Helsevirkninger av ernæringsindusert ketose
Våre forgjengere levde i flere millioner år periodisk eller kronisk i ketose, hvilket vil si at de ofte befant seg i kronisk fettforbrenningsmodus og var tilpasset bruk av ketoner som en viktig energikilde. Jordbruksrevolusjonen som startet for omkring 11 000 år siden, endret kostholdet drastisk fordi glukose gradvis ble den viktigste energikilden. I dag er kostholdet til flertallet av jordas befolkning dominert av karbohydrater. Nyere forskning viser entydige, positive virkninger av et ketogent kosthold og periodisk faste.
Tekst Dag Viljen Poleszynski
Kort fortalt
Våre forgjengere før jordbruksrevolusjonen befant seg ofte i ketose.
Energiomsetningen i kroppen kan i hovedsak basere seg på fettsyrer og ketoner.
Friske personer trenger ikke sukker fordi leveren lager nok glukose.
Forskning viser at et ketogent kosthold virker helsefremmende og kan forlenge levealderen.
Selv om et ketogent kosthold kan forlenger antallet friske år, er det opp til hver enkelt å foreta avveininger mellom kortsiktig nytelse og langsiktig nytte.
Å befinne seg i ketose betyr at en dominerende andel av energiomsetningen baserer seg på en kombinasjon av ketoner og fettsyrer, mens glukose spiller en mindre rolle for å danne energimolekylet ATP (adenosin trifosfat). Et viktig skille er mellom faste- eller ernæringsindusert ketose og diabetisk ketoacidose. Førstnevnte er helsebringende, mens sistnevnte kan være livstruende.
En god indikator på våre forgjengeres tilvenning til ketogen diett er at ketoner brukes som brensel særlig i hjernen, hjertet og skjelettmuskulatur i tilstander som inkluderer sult, ved ketogen kost og for alle nyfødte.1
Ketogent kosthold
Et ketogent kosthold domineres av fett og inneholder omkring 20–40 g glukose per dag. En rask metode for å komme i ketose er å faste, enten periodisk eller flere dager. Når vi er i ketose, nedbryter kroppen fettreserver, som frigir glyserol (som gir litt glukose) og fettsyrer, hvorav en del omdannes til ketoner. Disse kan brukes av hjernen og en rekke andre vev i stedet for glukose.
Man kan måle graden av ketose eller i hvilken grad man forbrenner kroppsfett ved hjelp av blodprøver eller ved å måle ketoner i pusten. I førstnevnte tilfelle måles konsentrasjonen av ketonet beta-hydroksibutyrat (en variant av smørsyre), mens man i sistnevnte måler pustens konsentrasjon av aceton («neglelakkfjerner») i ppm (deler per million). Nytten av sistnevnte målemetode diskuteres i en egen sak.
Man befinner seg i ketose hvis konsentrasjonen av ketoner i blodet er >0,5 mmol/L, og et maksimalt oppnåelig nivå for friske personer er 7–8 mmol/L. Et terapeutisk nivå for ketoner ligger i området 2–7 mmol/L eller tilnærmet det samme som fastende blodsukker (4,5–5,5 mmol/L). Diabetikere kan ha tre-fire ganger høyere ketonverdier enn det maksimale friske kan oppnå. Definisjonen på diabetes er at fastende blodsukkernivå >8 mmol/L.
Diabetisk ketoacidose (syreforgiftning) oppstår hvis man lever på et kosthold rikt på stivelse/sukker samtidig som kroppens celler ikke klarer å nyttiggjøre seg dem enten på grunn av mangel på insulin (diabetes type 1), eller fordi cellene er blitt ufølsomme for insulin (insulinresistens) og derfor ikke tar opp glukose. Nivået av ketoner kan da komme opp i >25 mmol/L, hvilket kan være livstruende.
Ketoner er ikke avfallsstoffer
Diabetesforbundet betegner ketoner som et ”avfallsstoff”, hvilket har vist seg å være feil.2 Dette trodde mange leger for 100 år siden, inntil det ble klarlagt at ketoner er viktig energisubstrat for friske, som ikke har behov for å innta så mye som ett eneste gram glukose. Normalt lager nemlig leveren all glukosen vi trenger. Kroppen prioriterer å tilføre glukose til celler som ikke inneholder mitokondrier (cellenes ”energifabrikker”): blodceller, noen celler i hjernen og noen nyreceller. Til sammen trenger disse cellene noen titalls gram per dag, noe som har vært kjent i omkring 50 år.3

Figur 1 viser hvordan ketoner i blodet henger sammen med ulike tilstander. Ernæringsindusert ketose eller en natts faste kan gi 0,5–1,0 mmol/L ketoner i blodet, mens et moderat nivå regnes å være opp mot 2 mmol/L. Etter trening på tom mage kan nivået komme opp i 3–4 mmol/L, mens faste kan gi verdier på omkring 5 mmol/L, maksimalt 7–8 mmol/L, altså høyere enn fastende blodsukker. Et terapeutisk nivå regnes å ligge i området 3–5 mmol/L, tilsvarende fastende blodsukkernivå.
Har man høyere ketonverdier enn 8 mmol/L samtidig som blodsukkernivået er over 13 mmol/L, nærmer man seg diabetisk ketoacidose, som kan være livstruende. Figuren viser forskjellige nivåer av blodketoner og deres betydning.
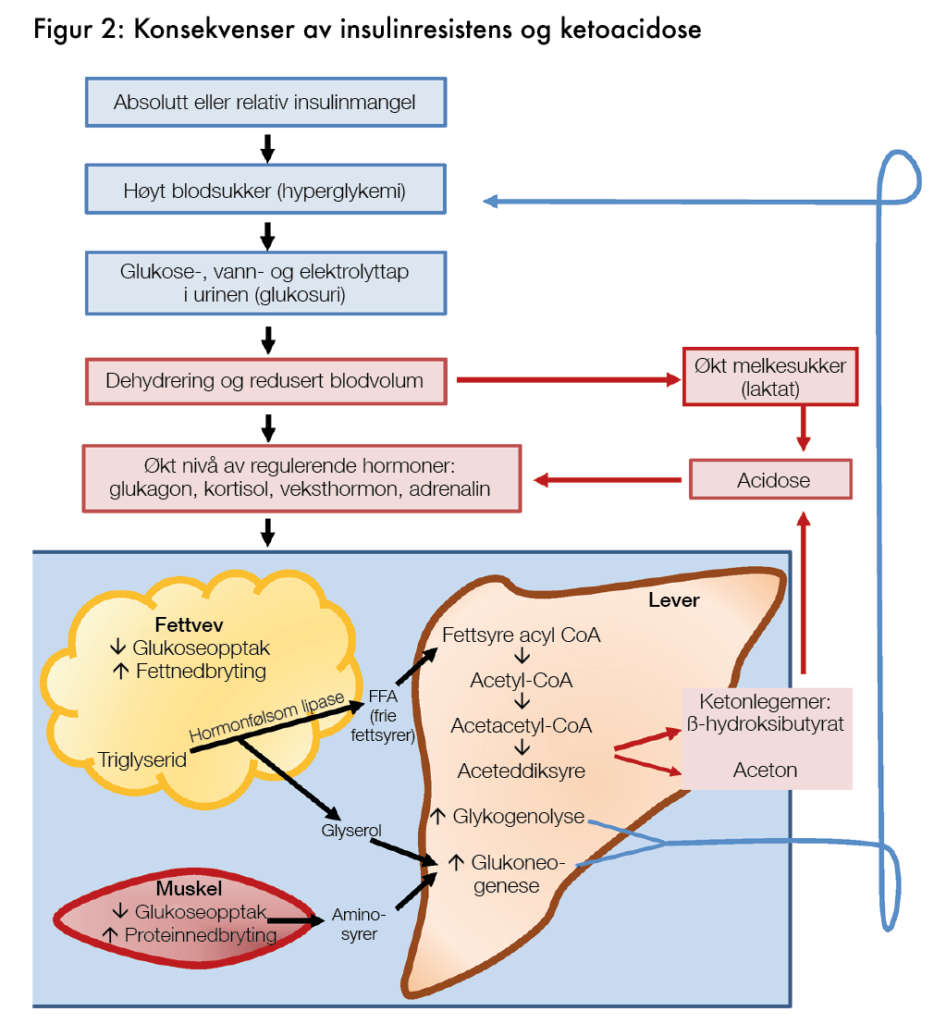
Diabetisk ketoacidose kan være livstruende fordi cellene ikke klarer å nyttiggjøre seg glukose. Siden kroppsvevene ikke er tilpasset bruk av ketoner, hoper de seg opp i blodet. Dermed kan blodets pH bli farlig lavt. Den umiddelbare årsaken er en absolutt eller relativ insulinmangel, som fører til et forhøyet nivå av sukker i blodet (hyperglykemi). Glukose er et reaktivt molekyl som kan binde seg til proteiner i blodårene og skape kryssforbindelser mellom bindevev, akkurat som eggehvite bruner skorpen når man steker brød (Maillard-reaksjoner4). Derfor beskytter kroppen seg mot et farlig høyt blodsukkernivå ved å skille ut sukker fra blodet til urinen. Dette medfører tap av vann og elektrolytter utenfor og inni cellene.
Diabetikere som går over til lavkarbokosthold, venner seg etter hvert til å bruke ketoner i stedet for glukose. Høyfettkosthold virker helbredende for de fleste med diabetes type 2, som ofte kan slutte helt med insulin. Ved type 1 blir insulinbehovet i slike tilfeller ofte drastisk mye lavere, i enkelttilfeller helt eliminert.
Ved diabetes forsøker kroppen å motvirke tap av glukose i urinen ved at bukspyttkjertelen skiller ut mer glukagon, noe som frigir glukose fra kroppens glykogenlagre. Samtidig skiller binyrene ut kortisol og adrenalin, som også bidrar til å nedbryte glykogen til glukose og fett til fettsyrer og glyserol. Sistnevnte kan leveren omdanne til glukose. Dessuten skiller hypofysen ut mer veksthormon, som også bidrar til å mobilisere kroppens glukosereserver. Fettvev klarer imidlertid ikke å absorbere og omdanne glukose til fett og frigir i stedet frie fettsyrer og glyserol ved hjelp av hormonfølsom lipase, mens musklene frigir aminosyrer (alanin), som leveren også kan omdanne til glukose. Alt dette skjer for å tilføre blodet mer glukose, som cellene ved langt framskredet diabetes ikke klarer å nyttiggjøre seg på grunn av insulinresistens.
Resultatet er at leveren danner mer ketoner (beta-OH-smørsyre, aceteddiksyre og aceton) og frigir enda mer glukose til blodet. Dette resulterer i enda høyere blodsukker og økt vanntap, samtidig med pH-fall i urinen på grunn av den økte konsentrasjonen av ketoner. Pusten gjenspeiler mengden produsert aceton, som lukter som neglelakkfjerner og lett kan måles.
Ovennevnte forhold skjer ikke med friske personer som lever på lavkarbokosthold, selv om enkelte ernæringsforskere feilaktig har hevdet at man må innta karbohydrater for å holde seg frisk.5 Tidligere professor i ernæring Wenche Frølich (f. 1946) har til og med uttalt at6 ”Det er farlig på sikt å kutte ut karbohydrater. Du må ha karbohydrater for at kroppen skal fungere, og for å forbrenne fett og proteiner.” Begge deler er direkte galt.
Helbredende virkninger av ketose
I motsetning til hva statsautoriserte ernæringsspesialister hevder, viser forskning og kliniske erfaringer at det generelt er helsebringende å være i ketose. En oversiktsartikkel fra juni 2021 oppsummerer de biokjemiske omdanningsveiene forbundet med kroppens bruk av ketoner og støtter seg til 285 fagfellevurderte artikler.7 Artikkelen tar utgangspunkt i gunstige virkninger av eksogent tilførte ketoner på aldringsprosesser og aldersrelaterte nevrodegenerative lidelser som Alzheimers sykdom, Parkinsons sykdom og amyotrofisk lateralsklerose (ALS), og diskuterer i detalj de biokjemiske omdanningsveiene forbundet med en tilstand av ketose. Forfatterne diskuterer også virkningene av kalorirestriksjon/faste og hvordan et antidiabetisk medikament (Metformin) og resveratrol (et fargestoff i planter, særlig rødvin) kan regulere en rekke parametere som er knyttet til aldringsprosessen. Figur 2 viser grunnlaget for deres detaljerte diskusjon av påviste og mulige mekanismer.
Den nevnte artikkelen gjennomgår figuren i detalj. Her er det kun plass til noen hovedtrekk. Poenget er å forklare hvordan aldringsprosessen foregår på cellenivå. Det viktigste budskapet her er at kalorirestriksjon og et ketogent kosthold virker gunstig på en rekke prosesser i cellene, i tillegg til at to medikamenter (rapamycin og Metformin) samt resveratrol kan motvirke tidlig aldring.
Cellulær aldring kan påvirkes ved hjelp av medikamenter som kalles senomorfiske, hvilket betyr at de forsinker aldringsprosessen. Ett slikt medikament er diabetesmedikamentet Metformin.8 Et annet er det naturlige polyfenolet resveratrol, som det finnes mye av i enkelte druer og i rødvin lagd av slike druer, bær og peanøtter.9 Et tredje er medikamentet rapamycin.

Figur 3 viser sentrale molekyler som påvirker aldring og kognitiv funksjon. Øverst starter den med insulin, som binder seg til cellenes reseptorer (mottakere), noe som har både positive og negative virkninger. Kalorirestriksjon og Metformin hemmer insulin og dannelsen av IGF1 (se nedenfor). Ketonet beta-hydroksibutyrat (βHB) stimulerer enzymet AMPK via membranproteinet HCAR2 (OH-karboksylsyre reseptor 2), altså en gunstig effekt. Cytokiner inkluderer en gruppe betennelsesmarkører som interleukiner og interferoner.10
De nevnte molekylene påvirker cellenes indre miljø via mottakere på cellemembranene, hvorav tre molekyler inni cellene er særlig viktige:
mTORC1 (kan hemmes av rapamycin), som virker negativt (lilla piler).
Enzymet AMPK (adenosin monofosfat-aktivert serin-treonin protein kinase), som virker positivt (grønne piler): det fremmer DNA-reparasjon, modifiserer acetylering av histoner og metylering av DNA, fremmer stamcellefornyelse og hemmer mTORC1 og betennelsesfremmende nukleær faktor kappa eller NF-kB/ROS (ROS: reaktive oksygenmolekyler).
SIRT1 (sirtuin 1, som virker positivt: brune piler).
mTOR er et bindingsprotein11 (enzym) som bidrar til cellevekst/-spredning, aktivering av insulinreseptorer og insulinliknende vekstfaktor 1 (IGF1). Enzymet er gjerne oppregulert ved kreft og kan hemmes av medikamentet rapamycin,12 som binder seg til mTOR og derved forhindrer de negative virkningene på proteinsyntese, autofagi (opprenskning) og PGC-1α (peroksisomproliferator aktivert reseptor gamma (PPARγ) koaktivator-1α).
Nederst i figuren vises de positive virkningene av nevnte molekyler, kalorirestriksjon og ketonet beta-hydroksibutyrat (βHB) på ni aldringsmarkører (blå piler):
- Proteinhomeostase (likevekt mellom nydanning og nedbryting)
- Ernæringsovervåkingsmekanismer (mTOR, insulinliknende vekst faktor IGF1)
- Epigenetiske endringer (”overstyring” av DNA)
- Mitokondriell feilfunksjon
- Forkorting av telomerer (endestykker til kromosomer)
- Ustabilt genom (økende antall DNA-skader)
- Tømming av stamcellereserver
- Cellealdring
- Kommunikasjon mellom celler
Samtlige av disse mekanismene kan påvirkes positivt eller negativt. Positive omdanningsveier er vist med blå piler og negative tilbakekoblinger (hemming med svart med kule på enden), mens svarte piler viser omdanningsveier som aktiveres.
Artikkelen diskuterer i detalj sammenhengene mellom faktorene og mekanismene nevnt ovenfor og de vanligste nervesykdommene Alzheimers og Parkinsons sykdom og amyotrofisk lateralsklerose (ALS), i tillegg til redusert læringsevne og hukommelse. I tillegg nevnes at tilstander som gjerne rammer eldre, inkludert osteoporose (beinskjørhet), hjerte- og karsykdommer, kreft, diabetes, muskeltap (sarkopeni) og osteoartritt (slitasjegikt), kan motvirkes ved en gunstig livsstil. Et ketogent kosthold virker livsforlengende ved å motvirke cellens aldring og dermed en rekke lidelser som er sterkt utbredt i vår tid.
Konklusjoner
Nyere forskning har klarlagt en rekke biokjemiske omdanningsveier som kan påvirkes positivt om man er i ketose. Et ketogent kosthold kan virke helbredende mot en rekke sykdommer og bidrar også til at kroppens aldringsprosesser går langsommere, det vil si at mange vil kunne forlenge livet og har høyere livskvalitet ved å spise ketogent. Siden vi alle er forskjellige, vil nytte variere fra individ til individ, og det er selvsagt opp til den enkelte å foreta avveiinger mellom langsiktige mål om levetid og helse i alderdommen og hvordan de ønsker å leve her og nå.
En egen artikkel gjennomgår en rekke lidelser/sykdommer der forskning og kliniske erfaringer med lavkarbo-/høyfettkosthold kan vise til gode erfaringer.
Kilder:
1 Cotter DG, d´Avignon DA, Wentz AE mfl. Obligate role for ketone body oxication in neonatal metabolic homeostasis. The Journal of Biological Chemistry 2011; 286: 6902–10.
2 https://www.diabetes.no/diabetes-type-1/behandling/blodsukker/syreforgiftning/
3 Drenik EJ, Alvarez LC, Tamasi GC mfl. Resistance to symptomatic insulin reactions after fasting. The Journal of Clinical Investigation 1972; 51: 2757–62. https://pubmed.ncbi.nlm.nih.gov/5056667/
4 https://snl.no/Maillard-reaksjoner
5 Flåm K, Svendsby E. Krigen om lavkarbo – her får du oversikten. VG 20.9. 2011. https://www.vg.no/forbruker/mat-og-drikke/i/wae7d/krigen-om-lavkarbo-her-faar-du-oversikten
6 16.9.2009. http://lavkarboliv.no/tag/wenche-frolich/
7 Kovács Z, Brunner B, Ari C. Beneficial effects of exogenous ketogenic supplements on aging processes and age-related neurodegenerative disease. Nutrients 2021; 13: 1–35. https://pubmed.ncbi.nlm.nih.gov/34206738/
8 Kim EC, Kim JR. Senotherapeutics: emerging strategy for healthy aging and age-related diseases. BMB Reports 2019; 621: 47–55. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6386227/
9 De la Lastra CA, Villegas I. Resveratrol as an anti-inflammatory and anti-aging agent: mechanisms and clinical implications. Molecular Nutrition 2005; 49: 405–30. https://onlinelibrary.wiley.com/doi/abs/10.1002/mnfr.200500022
10 Foster JR. The functions of cytokines and their uses in toxicology. International Journal of Experimental Pathology 2001; 82: 171–92. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2517710/
11 https://en.wikipedia.org/wiki/MTOR
12 Ballou LM, Lin RX. Rapamycin and mTOR kinase inhibitors. Journal of Chemical Biology 2008; 1: 27–36. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2698317/




